蛋白質など生体高分子の立体構造とその動的な性質(ダイナミクス)を解明し、機能との関係を理解します。そのためには、X線結晶構造解析や溶液NMRなどの既存技術だけでなく、X線自由電子レーザーや低温電子顕微鏡などの新しい技術を積極的に導入すると共に、高感度のNMR法を新たに開発するなど技術革新を行います。さらに、実験と計算科学を融合することで広い時空間における構造ダイナミクスの理解と予測を実現します。構造生物学だけでなく、物理学、化学、計算科学など異なる背景を持つ研究者が融合し、構造・ダイナミクス・機能の関係を理解し、分子細胞生物学における様々な課題の解決に取り組みます。
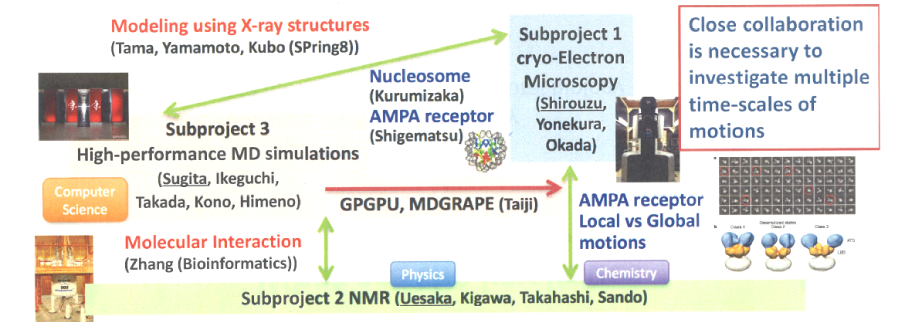
生きた細胞では、生体分子はいろいろな構造をとることで、様々な相手と複合体を形成し機能を発現します。そのため、生体分子がいかに動的な構造をとるのかを知ることは不可欠です。シリアルフェムト秒結晶学や時分割X線結晶構造解析により、ナノ秒から秒という幅広い時間分解能の構造動態の解析が可能です。さらに、近年、クライオ電子顕微鏡法は、検出器とソフトウェアの発展により、結晶化せずに、2Åを切る高分解能の構造を決定することが可能となってきました。また、複数の構造が混在した試料でも、サブnmの分解能で構造決定することも可能で、高性能計算資源と分子動力学シミュレーションにより、生体高分子の機能発現に伴う構造変化を、連続した変化として扱うことができるようになると考えられています。そこで、本サブプロジェクトでは、in vitroで決定した構造から、in vivoの生体高分子の機能構造を明らかにするために、高分解能の構造決定と併せて、複数の構造が混在する複雑な試料についてのクライオ電子顕微鏡法による解析を、分子動力学シミュレーションのグループと連携して動的構造生物学に取り組みます。 サブ課題1の研究内容
NMRは分子の構造やダイナミクスの詳細な情報を非侵襲に得ることのできる汎用性の高い分析手法であり、これまでに分子機能の発現におけるダイナミクスの重要性などを明らかにしてきました。 今後の重要な研究課題の一つである細胞内環境における生体分子の構造やダイナミクスの解析においては、原子分解能で解析できる唯一の手段(in-cell NMR)として大きな期待が寄せられていますが、NMRの最大の欠点である「低感度」がボトルネックとなってきました。 NMRの感度を劇的に改善する最後のフロンティアが、動的核偏極法(DNP: Dynamic Nuclear Polarization)による信号増大です。DNP法を持ちれば、NMRの信号源となっている「核スピン偏極率」を一万倍以上に大きくすることができ、これに伴いNMR信号強度も同じ率で増大します。本サブプロジェクトでは、低温環境の代わりにレーザーを使用する新しい偏極手法であるトリプレットDNP(光励起三重項電子スピンを用いた動的核偏極)を最大限活用し、可能な限り生体環境に近い温度・分子密度でのNMR測定を実現します。このグループのユニークな点は、生物学・化学・物理学の研究者が分野の壁を乗り越え、同じ夢に挑戦していることです。
化学者が生体分子にペンタセン誘導体分子(偏極源分子)を結合させ、物理学者が作成した専用DNPシステムで核偏極を増大し、そして生物学者が美しいNMRデータを基に生命の謎に挑んでいます。サブ課題2の研究内容
蛋白質など生体高分子の立体構造を用いた分子シミュレーション、特に分子動力学(MD)シミュレーションは近年の計算機の急速な発展に伴い、その適用範囲を拡大しています。しかし、MDシミュレーションだけではミリ秒あるいはそれより遅い時間スケールの大規模構造変化を予測することができません。このサブ課題では、低温電子顕微鏡や核磁気共鳴(NMR)などの実験から得られる情報を直接利用したデータ駆動の分子シミュレーション解析法を開発します。立体構造解析の解像度の向上に貢献するとともに、遅い分子運動や複雑な構造ダイナミクスの解析に取り組みます。生体膜中に存在する膜タンパク質やタンパク質核酸複合体、ヌクレオソームやクロマチンなどを主な研究対象として、構造解析グループと連携して構造ダイナミクスの研究に取り組みます。 サブ課題3の研究内容